更新时间:2024-01-15 15:00:01 浏览次数::507
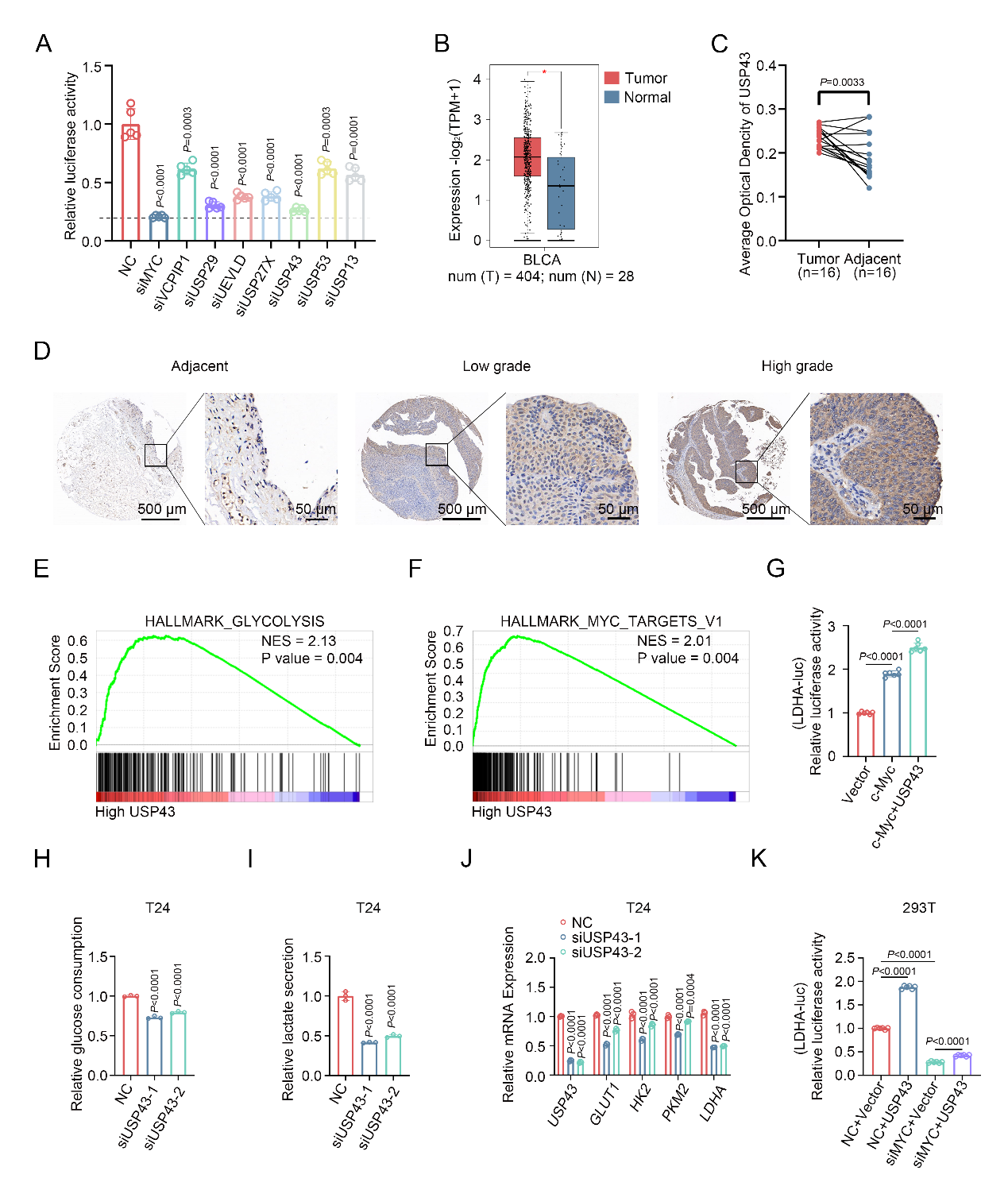
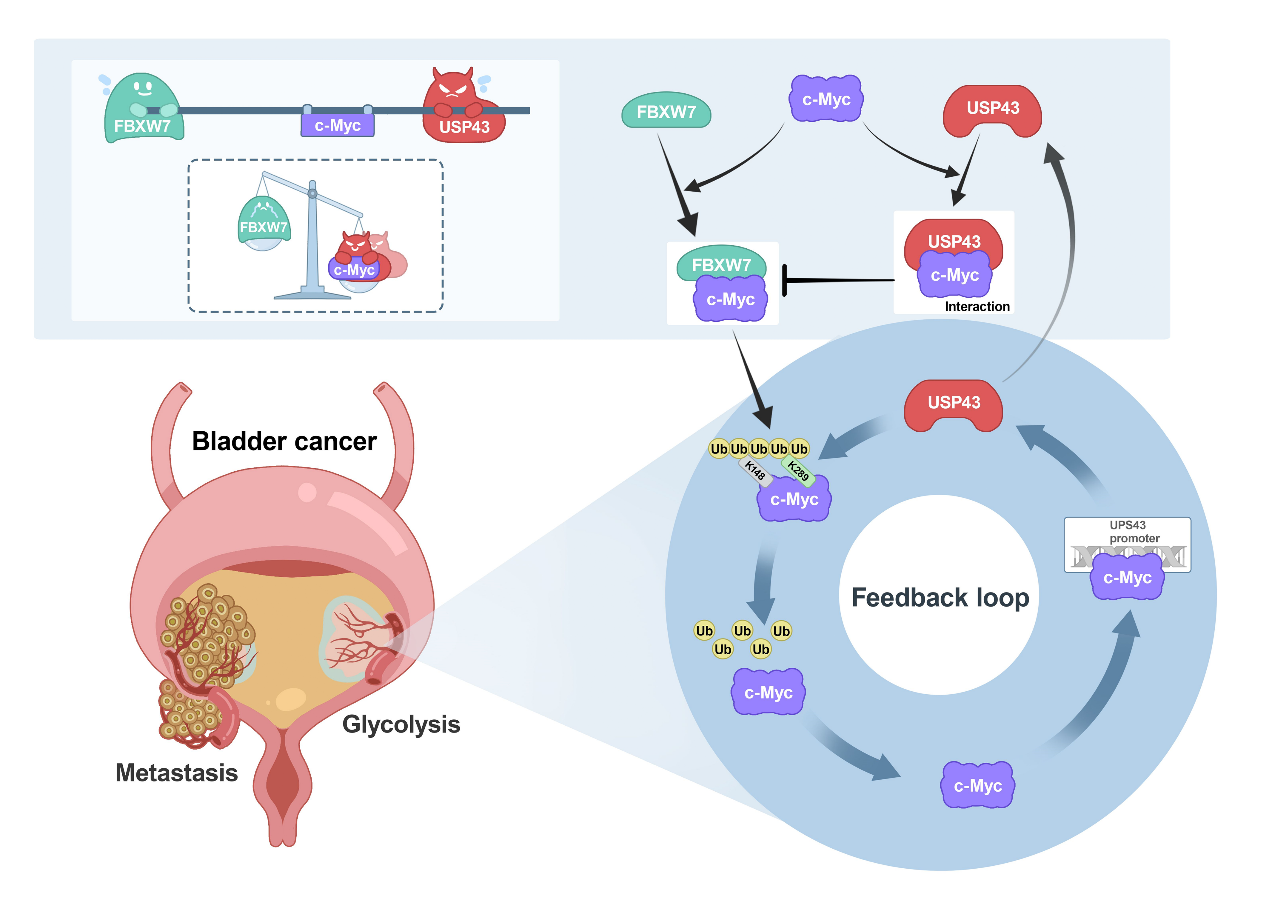
2024年1月13日,武汉大学中南医院泌尿外科王行环教授团队围绕膀胱癌中c-Myc蛋白的调控作用在Cell Death & Disease上发表最新研究成果“USP43 stabilizes c-Myc to promote glycolysis and metastasis in bladder cancer”[1]。该研究首先利用靶向去泛素酶的siRNA文库筛选出了一个能够调节糖酵解代谢和c-Myc转录活性的去泛素化酶——USP43,后续的功能实验和分子研究进一步研究揭示了USP43/c-Myc正反馈环路促进了膀胱癌的转移。(前期研究详见:Nature Communications | DNA聚合酶POLD1通过稳定MYC促进膀胱癌增殖转移;Oncogene | TRAIP通过催化MYC蛋白K48连接的多聚泛素化抑制膀胱癌进展) 众所周知,肿瘤细胞的一个显著特征是向有氧糖酵解代谢的特定转变,这种现象被称为Warburg效应。在膀胱癌中,经典原癌基因MYC的扩增和激活是导致这一转变的关键因素,其编码的蛋白c-Myc的靶向治疗尚存在巨大挑战,因此需要解析出更加详尽的c-Myc调控机制来发展选择性靶向治疗策略。 本研究在前人筛选的调控肿瘤细胞糖酵解的去泛素化酶的基础上[2],进一步利用去泛素化酶文库筛选出了正向调控c-Myc转录活性的去泛素化酶USP43,其在膀胱癌中高表达且与预后不良相关。随后的功能实验表明,USP43能够促进膀胱癌细胞的糖酵解和转移能力。 在分子机制方面,USP43主要通过去泛素酶活性将c-Myc的第148和289位赖氨酸的泛素链修饰移除,从而稳定c-Myc蛋白。此外,膀胱癌中上调的USP43蛋白也增加了其与c-Myc相互作用的机会,干扰了FBXW7对c-Myc的结合和降解。值得注意的是,本研究还发现c-Myc可以作为USP43的转录因子,激活USP43的转录,从而在膀胱癌中形成了一个正反馈环路。这一环路有助于加速膀胱癌细胞的糖酵解和转移过程。 总的来说,本研究深入揭示了USP43调控糖酵解和c-Myc转录活性的机制,丰富了膀胱癌的致病机理研究,为膀胱癌的靶向治疗提供了新的潜在靶点。值得注意的是,针对USP43的药物开发不仅需要抑制其去泛素酶活性,还需要降解USP43蛋白或破坏其与c-Myc的相互作用,以获得最佳疗效。该论文第一作者为武汉大学中南医院泌尿外科博士研究生李明星,该项目受到国家自然科学基金、湖北省科技厅及武汉大学中南医院的科研经费支持。 参考文献 [1] Li, M., Yu, J., Ju, L. et al. USP43 stabilizes c-Myc to promote glycolysis and metastasis in bladder cancer. Cell Death Dis 15, 44 (2024). doi:10.1038/s41419-024-06446-7. [2] Tu R, Kang W, Yang M, et al. USP29 coordinates MYC and HIF1α stabilization to promote tumor metabolism and progression. Oncogene. 2021;40(46):6417-6429. doi:10.1038/s41388-021-02031-w. 原文链接: https://www.nature.com/articles/s41419-024-06446-7